Учебная работа. Доклад: Первое начало термодинамики
При переходе системы из состояния A в состояние B сумма работы и теплоты, приобретенных системой от окружающей среды, определяется лишь состояниями A и B; эта сумма не зависит от того, каким методом осуществляется переход из A в B.
Это значит, что существует таковая величина E, характеризующая внутреннее состояние системы, что разность ее значений в состояниях Aи Bопределяется соотношением
EB–EA=Q–L,
(1)
где (–L)– работа, совершенная средой над системой, а Q– количество тепла, приобретенное системой от окружающей среды (количество энергии, передаваемое системе тепловым образом, т.е. в форме, хорошей от работы).
Величина Eназывается внутренней энергиейсистемы.
Для нескончаемо малого конфигурации состояния
dE=?Q–?L,
(2)
либо, используя выражение для ?L,
dE=?Q–PdV.
(3)
Таковым образом, изменение внутренней энергии системы равно сумме приобретенного тепла и совершенной над системой работы. (1)
Пример:Разглядим систему, состоящую из определенного количества воды в сосуде. Энергию системы можно прирастить 2-мя способами. 1-ый: можно нагревать сосуд на огне. При всем этом размер воды практически не возрастает, т.е. dV=0и, как следует, работа не делается. 2-ой путь: опустим в воду установку с вращающимися лопастями и методом трения увеличим температуру воды до такого же значения, что и в первом случае. Конечные состояния системы и приращения ее энергии в обоих вариантах одни и те же, но во 2-м случае повышение энергии обосновано работой.
Эквивалентность теплоты и механической работы становится в особенности ясной, если разглядеть повторяющийся процесс. Потому что изначальное и конечное состояния цикла схожи, то изменение энергии равно нулю (EA=EB)и, как следует,
L=Q,
(4)
т.е. работа, совершенная системой во время цикла, равна количеству теплоты, поглощенному системой. (4)
Теплота измеряется в единицах энергии – эргах, джоулях и калориях. Соотношение меж джоулем и калорией имеет вид
1 кал=4.18 Дж .
(5)
Это – механический эквивалент теплоты.
Величины Qи Lне являются функциями состояния системы; они зависят от метода перехода из состояния Ав В. Соответственно этому ?Qи ?Lне являются полными дифференциалами. Это событие и отмечается внедрением знака ?, а не d. (1)
Применим 1-ый законк системам типа однородной воды, состояния которых определяются 2-мя из 3-х переменных P, Vи T. В этом случае неважно какая функция состояния системы и, а именно, внутренняя энергия Eбудет функцией 2-ух переменных, избранных в качестве независящих.
Чтоб избежать неверного толкования того, какая переменная является независящей при вычислении личной производной, будем заключать знак личной производной в скобки и помещать понизу скобок ту величину, которая при личном дифференцировании остается неизменной. Таковым образом,
(? E/? T)V
значит личную производную Eпо Tпри неизменном V; при этом Tи Vвзяты в качестве независящих переменных. Эта производная различается от личной производной (? E/? T)P , при взятии которой остается неизменным давление P. (3)
Разглядим сейчас нескончаемо малый процесс, т.е. процесс, при котором независящие переменные меняются на нескончаемо малые величины. Для такового процесса 1-й законтермодинамики можно переписать в виде
?Q=dE+PdV
(6)
Если в качестве независящих взять переменные Tи V, то E=E(T, V)и, как следует,
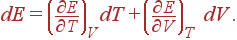
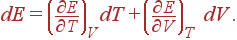
Соотношение воспринимает тогда вид:
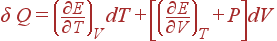
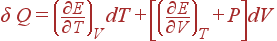
(7)
Если считать независящими переменными Tи P, то
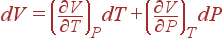
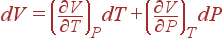
и воспринимает вид
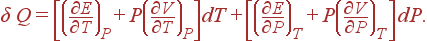
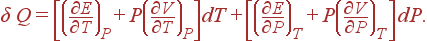
(8)
Теплоемкость тела определяется как отношение нескончаемо малого количества поглощенной теплоты к нескончаемо малому изменению температуры, вызванному данной нам теплотой.
Разумеется, что величина теплоемкости зависит от того, греется ли тело при неизменном объеме либо при неизменном давлении. Обозначим знаками cVи cPтеплоемкости при неизменном объеме и при неизменном давлении соответственно. Так как при V=const, dV=0, то
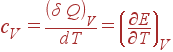
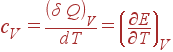
(9)
Схожим же образом из (8) выходит выражение для cP:
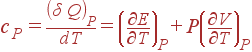
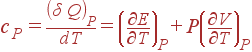
(10)
2-ой член в формуле для cPсвязан со слагаемым PdV, т.е. обрисовывает эффеккт, оказываемый на теплоемкость работой, которую система совершает во время расширения. В (9) подобного члена нет, так как размер остается неизменным и работа не совершается. (1)
В почти всех вариантах комфортно воспользоваться понятием молярной теплоемкости. Молярной теплоемкостьюназывается теплоемкость 1-го моля вещества. Молярные теплоемкости при неизменном Vи при неизменном Pопределяются формулами (9) и (10), если заместо случайного количества вещества взять 1 моль:
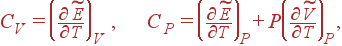
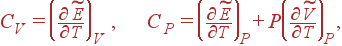
(11)
символ 

В случае газа можно конкретизировать зависимость внутренней энергии Eот переменных Tи V, определяющих его состояние. В предстоящем мы докажем, что энергия безупречного газа определяется температурой Tи не зависит от размера V: E=E(T).Для настоящих газов это утверждение производится приближенно. Для определения зависимости E(T)воспользуемся плодами опыта, согласно которым теплоемкость газов весьма слабо зависит от температуры. Можно представить, что для безупречного газа она строго постоянна. Тогда интегрирование уравнения
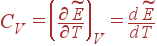
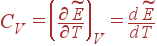
(12)
при условии CV=constдает:
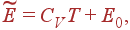
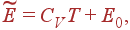
(13)
где E0–константа, представляющая энергию газа при абсолютном нуле.
Внутренняя энергия Nмолей газа
E=N(CVT+E0) .
(14)
Для безупречного газа 1-й законтермодинамики воспринимает вид
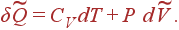
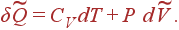
(15)
Из этого уравнения просто получить соотношение меж молярными теплоемкостями CVи CP. Для этого перейдем от переменных Tи Vк переменным Tи P. Это можно создать, если взять дифференциалы от обеих частей уравнения состояния для 1 моля безупречного газа
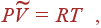
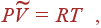
(16)
что дает
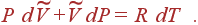
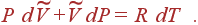
Выражая отсюда 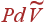
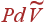
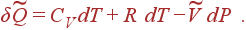
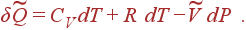
Отсюда можно просто отыскать CP. Так как при P=constдифференциал dP=0, то
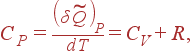
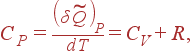
(17)
т.е. разность меж молярными теплоемкостями газа при неизменном давлении и при неизменном объеме равна газовой неизменной R . (1)
Перечень литературы
1.Мякишев Г.Я., Буховцев Б.Б. Физика 10 кл.
2.Шахмаев Н.М. Физика 10 кл.
3.Свитков Л.П. Термодинамика и молекулярная физика 1970г.
4.Билимович Б.Ф. Термо явления в технике1981г.
]]>
